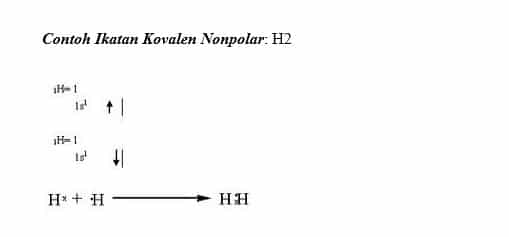
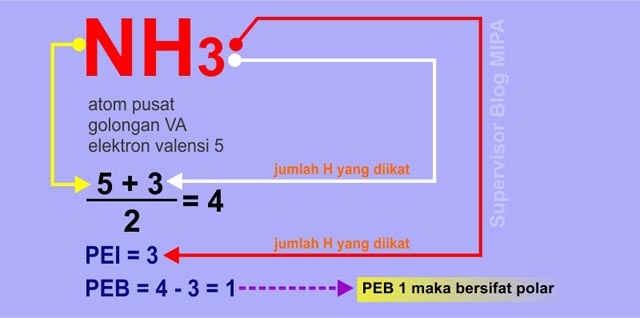
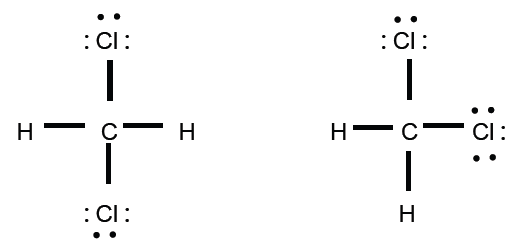
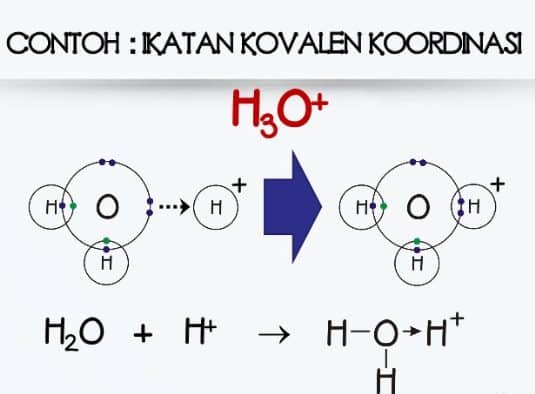
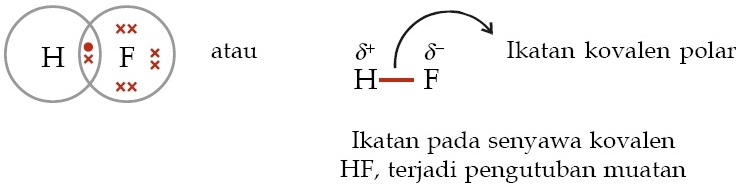
Air h2o amonia nh3 belerang dioksida so2 hidrogen sulfida h2s etanol c2h6o. Tidak ada peb diatom pusat 2.
Ikatan Kovalen Polar Dan Nonpolar Definisi Ciri Perbedaan
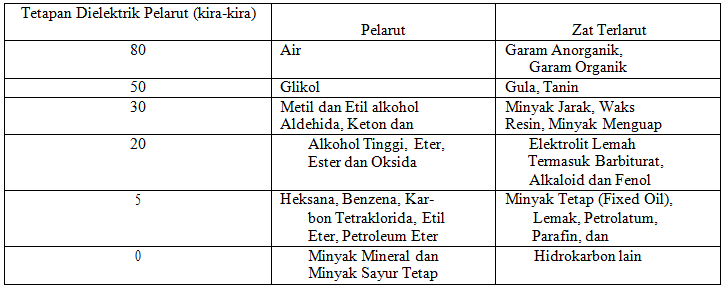
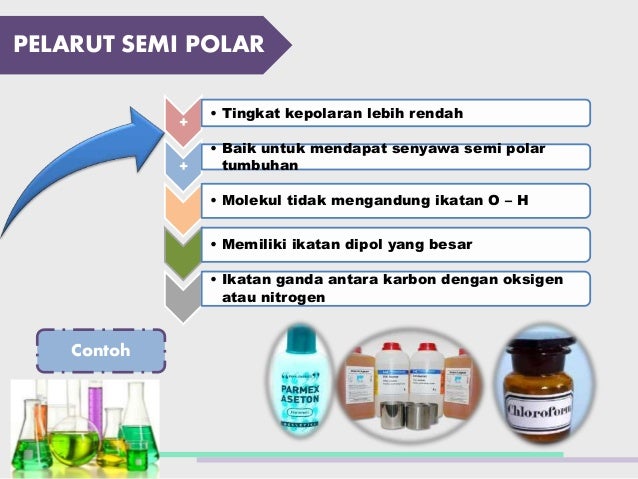
Contoh senyawa non polar. Perhatikan senyawa ionik seperti natrium klorida nacl bersifat polar. Jika perbedaan elektronegativitas antara atom lebih besar dari 20 ikatannya bersifat ionik. Pelarut non polar mengandung ikatan dengan atom elektronegatif yang sama seperti c dan h. Mempunyai atom yang elektronegatif tinggi seperti golongan 567 3. Cl2 pcl5 h2 n2. Susunan elekronnya simetris 3.
Mempunyai peb diatom pusat 2. Senyawa ionik adalah molekul yang sangat polar. Untuk dapat menentukan senyawa tersebut termasuk senyawa polar atau nonpolar kita harus mengetahui struktur lewis nya terlebih dahulu. Contoh pelarut non polar yaitu. Lihat juga materi kimia lainnya. Dalam hal ini untuk dapat membedakan kedua senyawa berikut ini yakni senyawa polar dan non polar yang dapat ditunjukan dari beberapa sisi yang diantaranya dari ciri senyawa distribusi elektronnya dan ukuran kuantitatif titik didih.
Ini terdiri dari molekul non polar dan dapat melarutkan senyawa atau zat terlarut non polar. Sususnan elektronnya asimetris 4. Senyawa polar dan non polar pengertian ciri kovalen perbedaan sifat titik didih contoh. Contoh senyawa lain yang memiliki bentuk molekul simetris dan bersifat nonpolar adalah ch 4 bh 3 bcl 3 pcl 5 dan co 2. Contoh molekul polar meliputi. Ok mari kita kerjakan.
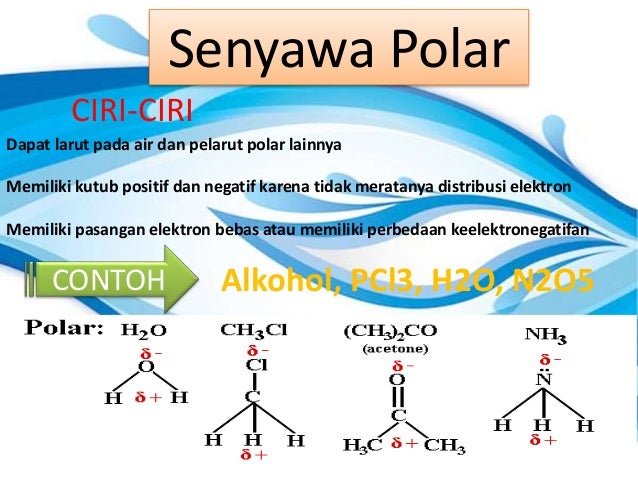
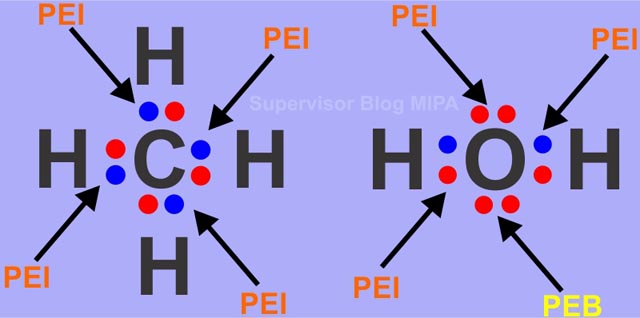
Ciri ciri senyawa polar dan non polar adalah. Perhatikan struktur salah satu ikatan kovalen non polar dari ch 4 berikut. Atomnya harus berbeda 5. Mempunyai unsur yang berkutub dan berkutub kalau non polar. Ikatan antara 8 o dengan 8 o.